Терпены и их производные — класс соединений, важных в практическом отношении и весьма интересных в теоретическом; большею частью вырабатываются и выделяются растениями в виде так наз. эфирных масел (см.), но известно также много искусственно получаемых представителей этого класса, которыми в последние лет 17 особенно обогатилась органическая химия и которые в значительной степени облегчили теоретическую разработку всего класса. Ныне, по разъяснении хим. строения большинства Т. и их произв. и установлении связи их друг с другом, равно как и с соединениями других классов, выделение всех этих соединений под общим приводимым выше именем является остатком старой, более грубой систематики, удерживаемой, однако, по некоторым соображениям, еще и до сих пор [Научная разработка рассматриваемых соединений, исключая отдельные незначительные наблюдения, началась, можно сказать, с 1803 г., с получения при пропускании хлористого водорода в скипидар аптекарем Киндом (Kind) хлористого пинена, названного тогда «искусственной камфорой». Вскоре последовал целый ряд многочисленных и весьма интересных исследований Saussure’a, Dumas, Deville, Berthellot, Tilden, Riban, Mongolfler и мн. др.; из русских ученых в том периоде имеются имена Орловского, Туголесова, особенно же много и плодотворно потрудились проф. Ф. М. Флавицкий и И. И. Канонников. Всеми этими трудами, однако, разъяснено было сравнительно немногое в смысле строения и установления взаимной связи отдельных представителей, и лишь работам последнего периода, который можно считать начавшимся с исследований Валлаха, публикованных с 1884 г., удалось пролить яркий свет на весь этот отдел: в этом периоде из весьма многочисленных работ особенно ценными следует считать труды лаборатории упом. выше Wallache, E. E. Вагнера в Варшаве, Бэйера, Бредта, Землера, Тиманна и др. Строение для большинства главнейших соединений и их производных было предложено Е. Е. Вагнером в 1894 г. и после тщательной проверки в разных лабораториях считается теперь отвечающим действительности и является общепринятым.]. Т. представляют углеводороды непредельные, эмпирической формулы — C5H8, способные к реакциям присоединения; в зависимости от присоединяющихся групп и элементов образуются соединения, заключающие галоиды, кислород, азот и up.; эти соединения, в свою очередь, путем разных реакций могут подвергаться изменениям, окислению и пр., образуя опять целый ряд соединений, являющихся производными Т. и стоящих более или менее близко к исходному Т. В дальнейшем описаны более важные Т. и рядом с ними главнейшие из их производных, следом же за Т. — те из более важных их производных, которые образуются из них не непосредственно, а окольными путями. Т. принято (не вполне удачно) разделять по величине частичной формулы на 4 класса: I) гемитерпены — C5H8, II) собственно Т. — C10H16, III) сесквитерпены — C15H24, IV) политерпены — (C5H8)n.
I. Гемитерпены представляют непредельные углеводороды с открытой углеродной цепью, обладающие двумя этиленными связями или одною ацетиленной, общей формулы СnН2n—2; из них упомянем лишь об изопрене, теснее связанном своими переходами с прочими Т. Изопрен С5Н8 образуется при сухой перегонке каучука, разложении жаром паров скипидара и проч. и представляет подвижную жидкость, кипящую при 35°—38°, уд. в. 0,682. Весьма интересным свойством изопрена является его способность легко полимеризоваться с образованием истинных Т. (C10H16); так, при нагревании в запаянной трубке при 250°—270° он переходит главным образом в дипентен С10Н16; под влиянием крепкой соляной кислоты рядом с хлоропродуктами образуется каучукоподобная масса; такая же масса получается, если изопрен долго подвергать влиянию света и проч. На основания всех известных данных изопрену должно приписать строение: СН2=С(СН3)—СН=CH2.
II. Собственно Т. C10H16 являются наиболее интересным и разработанным отделом Т. вообще. Число изомеров, сюда относящихся, до недавнего времени насчитывалось десятками, но благодаря работам Валлаха и др. доказано тождество между собою многих Т. разного происхождения, благодаря чему ныне число главнейших структурных изомеров низведено до 10—12 [Если принимать во внимание стереохимическую изомерию, то число изомеров возрастет (см. ниже).]; из них пинен, камфен, лимонен, сильвестрен, фелландрен и терпинен встречаются в природе, фенхен, карвестрен, терпинолен, туйен, борнилен и трициклен получаются искусственно. Встречающиеся в природе Т. входят в состав эфирных масел (см.).
Строение и номенклатура. Т. — непредельные соединения с одной или двумя этиленными связями [Трициклен — новый Т., не заключает, по-видимому, совсем этиленных связей; он описан Годлевским и Вагнером (Ж. 29, 121), но еще не обследован вполне.], следовательно, с циклической группировкой углеродных атомов; образование же из них под влиянием некоторых агентов цимола, равно как изучение прочих переходов и продуктов окисления, окончательно заставили считать Т. с двумя этиленными связями, построенными близко к дигидроцимолу. На Т. с одной этиленной связью в последнее лишь время установился взгляд как на бициклические соединения, второе кольцо которых образовано при участии изопропильной (цимольной) группы. Для образования номенклатуры Бэйер предложил назвать предельный циклический углеводород — гексагидроцимол — терпаном и от него уже, согласно правилам женевской номенклатуры (1892 г.), производить прочие названия; таким образом, углеводород с одной этиленной связью, т. е. тетрагидроцимол, будет называться — терпен, с двумя этиленными связями, т. е. дигидроцимол, — терпадиен и т. д. При такой, однако, номенклатуре является крупным неудобством необходимость приложения общераспространенного названия «терпен» к таким углеводородам, которые являются уже собственно не Т., а дигидротерпенами — С10H18. Для устранения этого неудобства Вагнер предложил за названием «Т.» удержать его теперешнее общее значение, называя им циклические углеводороды C10H16 разного строения, предложенную же Бэйером номенклатуру производить от тривиального названия гексагидроцимола — ментана, тогда тетрагидроцимол будет называться ментен, дигидроцимол — ментадиен, спирт формулы C10H17OH — ментенол и т. д. Мы далее будем придерживаться Вагнеровской номенклатуры. Кроме того, укажем, что знак Δ согласно предложению Бэйера принят для обозначения двойной связи, причем сверху ставятся маленькие цифры, указывающие, от которого по счету атома углерода идет двойная связь; если в состав ее входит не следующий по счету атом углерода, то ставятся цифры, указывающие, к которому атому направлена двойная связь; в последнем случае цифра ставится в скобках. Для большей наглядности приведем два следующих примера:
Для бициклических производных предельным углеводородом следует считать C10H18 — дигидропинен или дигидрокамфен, и Бэйер предложил для него название «камфан», от которого можно производить все остальные наименования; это название привилось только к производным камфорной группы, оказавшись неудобоприложимым к производным пинена, так как пинен, камфен, камфорные и др. производные имеют разные скелеты.
В самое недавнее время Бэйер предложил новые принципы для номенклатуры бициклических соединений, которые с легкостью распространяются и на бициклические Т. и их производные.
Общая характеристика. Т. C10H16, за исключением камфена (темп. пл. 49°) и открытого в прошлом году Вагнером и Брикнером борнилена (темп. пл. 98°), все представляют подвижные жидкости характерного ароматного, отчасти смолистого запаха; сильно преломляют свет; уд. вес их колеблется около 0,85, темп. кип. между 155° и 190°. Растворимость, летучесть и пр. свойства — общие всем непредельным углеводородам. Большинство Т. и их производных должны вращать плоскость поляризации, так как почти во всех них имеются асимметрические угли, но деятельные изомеры в отдельности известны далеко не для всех рацемических представителей. Из химических свойств, кроме обусловленной присутствием этиленной связи способности присоединять разные элементы и группы, Т. обладают сильно развитой изомеризационной способностью, объясняющей переходы их под влиянием кислой среды, повышенной температуры, света и пр. друг в друга, а иногда даже и в представителей иных отделов (бициклических в моноциклические и пр.); далее, у них сильно развита и полимеризационная способность, проявляющаяся как в условиях, вызывающих изомеризацию, так и при окислении на воздухе, чему Т. вообще легко поддаются; при этом они густеют и осмоляются. Свойства производных Т. не обладают такими правильностями, чтобы можно было их свести к общему описанию, и иногда дают неожиданные отклонения. В качестве общих реакций, способствовавших разработке и разъяснению свойств и строения терпенных соединений, являются след. 1a) Присоединение галоидоводорода (HCl, HBr, HJ — вообще НХ) происходит в соединениях моноциклических только по месту этиленной связи, причем, смотря по условиям реакции, можно изолировать образующийся вначале продукт присоединения НХ по месту одной связи, равно как и окончательный продукт, дигалоидгидрат — C10H16·2HX; в соединениях бициклических присоединение происходит или по месту одной из кольцевых связей с изомеризацией продукта (монохлоргидрат пинена), или только по месту этиленной связи с образованием моногалоидгидрата, или же в условиях, способствующих гидратации, и с разрывом одного из 2-х колец, при чем получается продукт уже моноциклический. Введение элементов НХ можно воспроизвести и иным путем, обменивая водный остаток соответственных спиртов на галоид обычным образом, напр. галоидными соединениями фосфора и пр. 1b) Отнятие галоидоводорода происходит или в направлении, обратном присоединению, при чем регенерируется первоначальный продукт, или в ином направлении, как это часто имеет место и в жирном ряду, при чем получается иное соединение; если в продукте, от которого отнимается НХ, находится водный остаток, то весьма часто и он принимает участие в потере частицею элементов НХ, при чем тогда замыкается окисное кольцо. В качестве отнимающего НХ средства чаще всего пользуются едкой щелочью или органическими основаниями (анилин, хинолин и проч.). 2а) Присоединение воды происходит, в зависимости от условий гидратации, или по месту этиленных связей, или в бициклических соединениях, иногда не трогая даже этиленных связей, с раскрытием одного из колец; при этом образуются одноатомные или многоатомные спирты; введение водных остатков можно реализовать также, обменивая в галоидопроизводных галоид на водный остаток, но как дальше указано, при этом могут образоваться соединения с иным пространственным расположением атомов, нежели при прямом введении гидроксилов — стереохимические изомеры. 2b) Отнятие элементов воды происходит, как и при галоидопроизводных, разно, причем в случае присутствия нескольких водных остатков могут и здесь образовываться окисные кольца. 3а) Присоединение галоидов (главным образом брома) в соединениях моноциклических происходит по месту двойной связи, причем можно изолировать продукты присоединения как 2, так и 4 ат. брома, т. е. по месту обеих этиленных связей; в соединениях бициклических присоединение галоидов иногда идет сразу неправильно, и первые же продукты присоединения 2 ат. галоида не соответствуют исходному веществу, а представляют уже продукты изомеризации. 3b) Отнятие галоидов совершается разно: либо под влиянием щелочи в виде галоидоводорода, и тогда происходит, как указано в 1b, либо его производят металлическим натрием или цинковой пылью в спиртовом растворе или в уксусной кислоте при охлаждении, причем в уксусной кислоте реакция идет в нескольких определенных направлениях в зависимости от положения галоидов. 4а) Присоединение водных остатков (2OH) производится или присоединением галоидов к исходному соединению и обменом их на водные остатки, или окислением исходного вещества в слабых водных растворах марганцово-калиевой солью. Кроме того, известен в терпенном ряду еще случай присоединения 2OH, получивший название «реакции Собреро» и состоящий в том, что, напр., скипидар, плавающий на воде, подвергают в атмосфере кислорода действию солнечных лучей; эта реакция не оказалась полезной при попытке дать ей более общее применение. 4b) Отнятие водных остатков производится обменом их на галоиды и затем по обычному правилу отнятия последних (см. 3b). 5а) Присоединение хлористого нитрозила (NOCl) является довольно важной реакцией в ряду терпенных соединений и именно по следующим соображениям: 1) в большинстве случаев получаются кристаллические соединения, что дает возможность по точке плавления последних характеризовать и определять исходные вещества; 2) в случае присутствия в соединении двойной связи в положении третично-третичном >С=С< получаются соединения голубого цвета (Thiele), так что иногда по цвету можно судить о строении исходного вещества, и 3) при обработке хлоронитрозопродукта едкой щелочью или аминами получаются в известных случаях соединения иного класса, часто кристаллические и могущие служить для характеристики исходных соединений и их переходов (см. ниже). При присоединении NOCl по месту этиленной связи между вторичным и третичным углями, группа NO становится ко вторичному углю, a Cl — к третичному; кроме того, часто получаются продукты уплотнения 2 частиц — бис-нитрозильные производные — для пинена и лимонена, напр., C10H16Cl.N2O2.C10H16Cl. 5b) Для отнятия хлористого нитрозила нет общего прямого пути, и приходится пользоваться более сложными многофазными реакциями, дающими в результате продукты иного класса. Имеющийся хлоронитрозопродукт обыкновенно обрабатывают вначале едкой щелочью, при чем удаляется HCl; при этом, если группа NO находится при третичном углероде, то она не изменяется и получаются нитрозопродукты, если же при вторичном, то она превращается в группу = N—OH; образуется, след., оксим, из которого уже обычным путем получается соотв. кетон. Нитрозо- и оксимидопроизводные можно водородом в момент выделения, особенно в кислой среде, перевести в аминные производные, которые, в свою очередь, при посредстве азотистонатриевой соли переводятся в спирты. При действии на хлоронитрозопродукты аммиака или аминов реакция протекает в нескольких направлениях: или 1) нормальным для аминов путем, т. е. обменом хлора на аминный остаток, при чем получаются нитролоамины:![]() ; нитрозогруппа в случае вторичного ее положения и при этой реакции переходит в оксимидную (образуется оксим); или же 2) отщепляется лишь HCl и, наконец, 3) известен один случай отклонения направления реакции от обоих описанных выше; это действие на хлоронитрозопинен анилина, при чем регенерируется в химически чистом состоянии исходный углеводород — пинен, но уже утративший свою первоначальную оптическую деятельность; анилин при этом переходит в амидоазобензол: C10H16NOCl + 2C6H5NH2 = H2O + HCl + C6H5N=NC6H4NH2 + C10H16. Кроме NOCl, кристаллические продукты присоединения способны давать азотистый (N2O3) и азотноватый (N2O4) ангидриды, которые присоединяются в виде групп нитрозонитритной и нитрозонитратной, причем в первом случае получаются нитрозиты, а во втором — нитрозаты; и те, и другие соединения способны под влиянием аминов обменивать группы —ΟΝΟ и —ONO2 на аминный остаток, при чем образуются упомянутые выше нитролоамины. 6) Присоединение хлорноватистой кислоты HClO по отношению к некоторым Т. и их произв. также дало некоторые ценные результаты. Оно происходит по месту этиленной связи, причем правильности в присоединении Cl и ОН не наблюдается. В соединениях бициклических, как и при галоидоводородах, может происходить и раскрытие одного из двух колец. Кроме указанного направления, происходит образование и иных продуктов состава С10Н16Cl2 (пинен, камфен); их образование и строение еще не разъяснено. При действии щелочей на продукты присоединения HClO происходит отнятие галоида и водорода водного остатка с образованием окисей. 7) Превращение моноциклических Т. в соотв. бензольные производные, дающее возможность определить положение боковых цепей, предложено Бэйером по след. способу: Т. превращают в бромгидрины; последние в избытке брома с примесью йода подвергают глубокому обромлению, при чем образуется обыкн. 7-бромистое производное по схеме, напр., для лимонена:
; нитрозогруппа в случае вторичного ее положения и при этой реакции переходит в оксимидную (образуется оксим); или же 2) отщепляется лишь HCl и, наконец, 3) известен один случай отклонения направления реакции от обоих описанных выше; это действие на хлоронитрозопинен анилина, при чем регенерируется в химически чистом состоянии исходный углеводород — пинен, но уже утративший свою первоначальную оптическую деятельность; анилин при этом переходит в амидоазобензол: C10H16NOCl + 2C6H5NH2 = H2O + HCl + C6H5N=NC6H4NH2 + C10H16. Кроме NOCl, кристаллические продукты присоединения способны давать азотистый (N2O3) и азотноватый (N2O4) ангидриды, которые присоединяются в виде групп нитрозонитритной и нитрозонитратной, причем в первом случае получаются нитрозиты, а во втором — нитрозаты; и те, и другие соединения способны под влиянием аминов обменивать группы —ΟΝΟ и —ONO2 на аминный остаток, при чем образуются упомянутые выше нитролоамины. 6) Присоединение хлорноватистой кислоты HClO по отношению к некоторым Т. и их произв. также дало некоторые ценные результаты. Оно происходит по месту этиленной связи, причем правильности в присоединении Cl и ОН не наблюдается. В соединениях бициклических, как и при галоидоводородах, может происходить и раскрытие одного из двух колец. Кроме указанного направления, происходит образование и иных продуктов состава С10Н16Cl2 (пинен, камфен); их образование и строение еще не разъяснено. При действии щелочей на продукты присоединения HClO происходит отнятие галоида и водорода водного остатка с образованием окисей. 7) Превращение моноциклических Т. в соотв. бензольные производные, дающее возможность определить положение боковых цепей, предложено Бэйером по след. способу: Т. превращают в бромгидрины; последние в избытке брома с примесью йода подвергают глубокому обромлению, при чем образуется обыкн. 7-бромистое производное по схеме, напр., для лимонена:
Образовавшийся продукт подвергают затем энергичному восстановлению цинком в кислой среде и натрием, причем часть брома отнимается, часть же замещается водородом, и образуются производные бензола, напр., в данном случае парацимол СН3—С6H4—С3Н7; в других случаях получены метацимолы, что и указывает на иное строение исходных Т. 8) В заключение остается еще рассмотреть реакции окисления, имевшие, как и вообще при установлении строения, решающее значение при разработке строения Т. и их производных. Применяемые в терпенном ряду реакции окисления в общем можно разделить на две группы: на окисление в кислой среде и на окисление в щелочной или нейтральной среде. Первыми были употреблены, как бывшие вообще в большем ходу, кислые окислители — азотная кислота и хромовая с серной или уксусной, но результаты окисления в свое время не дали ожидаемых указаний, как отчасти по новизне и неизвестности строения полученных кислот, так, с другой стороны, и по невозможности объяснить связь некоторых образовавшихся кислот [При окислении скипидара азотной кислотой были получены толуиловая и терефталевая кислоты, равно как терефталевая при окислении хромовой смесью.] с исходным веществом. Впоследствии лишь была еще раз подтверждена уже доказанная раньше способность Т. легко изомеризоваться под влиянием кислот, при чем было подмечено образование в этих условиях цимола — виновника загадочного образования ароматических кислот. Несмотря, однако, на изомеризующее влияние, кислые окислители принесли и продолжают приносить немалую пользу в тех случаях, когда окисление не ведется слишком глубоко или когда изомеризационный процесс ослаблен либо присутствием в частице каких-нибудь оказывающих влияние групп, либо понижением температуры и т. п. Гораздо плодотворнее оказались в терпенном ряду нейтральные или щелочные окислители, и на первое место следует поставить окисление марганцово-калиевой солью: оно-то, главным образом, и пролило свет на строение Т. и их произв.; далее к числу щелочных окислителей следует причислить окисление бромом в щелочном растворе, каковой окислитель оказывается особенно полезным при окислении в карбоксил ацетильной группы, т. е. кетонных производных с метилом при карбониле; реакция протекает по общеизвестной схеме образования хлороформа и уксусной кислоты из ацетона. Наконец, к окислению в нейтральной среде следует причислить и окисление α-оксикислот в кетоны или альдегиды нагреванием их с влажной перекисью свинца в струе водяного пара; реакция протекает по схеме:
> С—ОН—СООН + О = > СО + СО2 + H2O.
Перечисленными реакциями далеко не исчерпываются реакции, оказавшиеся плодотворными при разработке отдела Т., но остальные имеют уже более частный характер.
Отдельные представители и их производные. 1) Т. с одной этиленной связью (бициклические). Пинен, Δ2-2-метил-6-диметилбицикло-[1,1,3]-гептен
представляет один из наиболее распространенных в природе Т. (см. Терпентинное масло) и известен во всех трех оптических видоизменениях, причем недеятельный получается искусственно из деятельного через хлоронитрозосоединение. В чистом виде пинен представляет бесцветную жидкость, без запаха, кипящую при 155°—156°; d°0 = 0,8769; [α]D = +45,04° и —43,4°. Реагирует, как соединение с одной этиленной связью; легко изомеризуется, переходя нередко в Т. с двумя этиленными связями; так, под влиянием йода переходит, главным образом, в цимол, серная кислота переводит его в смесь камфена с цимолом, нагревание при 250°—270° — преимущественно в дипентен; подобное же влияние оказывают разведенные кислоты и проч. На воздухе в присутствии влаги и особенно щелочей пинен легко окисляется и осмоляется. Строение его установлено, главным образом, по окислению и переходу во влажном кислороде в собрерол. Главнейшие из производных пинена образуются при указываемых ниже реакциях. Присоединение хлористого водорода к пинену является первой реакцией, воспроизведенной искусственно в терпенном ряду; несмотря, однако, на почти 100-летнее знакомство с нею и громадное теоретическое значение ее, реакция эта лишь в самое последнее время начинает получать удовлетворительное разъяснение. Образование кристаллического монохлоргидрата C10H16·HCl сопровождается некоторой изомеризацией; по Вагнеру и Землеру, монохлоргидрату пинена принадлежит следующая конфигурация, образовавшаяся с изомеризацией пиненного ядра в камфорное:
Этот хлоргидрат тождествен с хлоргидрином борнеола (см. дальше камфен) и по виду и по многим своим свойствам очень напоминает обыкн. камфору; он плавится при 125° и кипит при 207°—208°. В присутствии хоть следов влаги образуется не монохлоргидрат, а дихлоргидрат, тождественный с дихлоргидратом лимонена (дипентена):
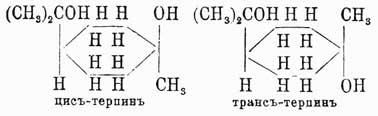
Дихлоргидрат представляет кристаллич. массу, плавящ. при 50° и кипящую (при 10 мм давл.) при 118°—120°; оптически недеятелен даже при образовании из деятельных Т., и это находится в полном согласии с переходом в дихлоргидрате всех асимметрич. углеродов исходного соединения в симметрические. Монохлоргидрат как таковой при обработке хлористым водородом ни в каких условиях не переходит в дихлоргидрат и поэтому не должен быть рассматриваем как промежуточный продукт образования последнего. Отнятие HCl протекает разно для обоих галоидгидратов; монохлоргидрат очень прочен, и удаление из него хлора происходит лишь при весьма энергичных условиях; при этом получается уже не исходный пинен, а камфен. Дихлоргидрат при отнятии HCl тоже не регенерирует пинена, а дает дипентен, и эта реакция, воспроизведенная в 1849 г., была первым случаем перехода от пинена к лимонену. Присоединение элементов воды при действии на пинен уксусной или муравьиной кислот при различных температурах дает смесь одноатомных спиртов C10H17OH, из которых два представляют соединения, не заключающие этиленной связи, след., бициклические (борнеол и фенхиловый (?) спирт), и третий непредельный — терпинеол (Δl-ментен-8-ол). Образование борнеола аналогично образованию монохлоргидрата пинена. Терпинеол кристалличен, плав. при 34°, кип. при 218° и, полученный из оптически деятельного исходного вещества, вращает плоскость поляризации: [α]D = —117°5′. Присоединение 2H2O к пинену происходит под влиянием водных кислот, при чем образуются кристаллы с 1 част. кристаллизационной воды состава С10Н20О2·H2О. Кристаллы эти — терпингидрат — плав. при 116°—117°; при перегонке сначала отщепляется кристаллизационная вода, и затем при 258° гонится безводный терпин, плавящ. при 104°—105°. Присоединение воды можно реализовать, присоединяя к пинену галоидоводород и обменивая галоид на водный остаток. Полученный таким путем терпин из дигалоидгидрата пинена (дипентена) оказался, однако, не тождественным с терпингидратом, равно как оказались не тождественными дигалоидгидраты, полученные непосредственно присоединением галоидоводорода к Т. и полученные обменом на галоид водных остатков терпингидрата. Новый терпин кристаллизуется без воды, плав. при 156°—158° и перегоняется при 263—265°; отвечающий ему дихлоргидрат уже описан выше (т. пл. 50°), дихлоргидрат же, получаемый из терпингидрата обменом его гидроксилов на хлор, плавится при 39°. Объясняется это явление при помощи стереохимических соображений о цис-транс-изомерии в ряду циклических соединений, причем, так как терпингидрат при дегидратации образует предельную окись — цинеол, которая способна снова переходить в терпингидрат, то последнему и приписывается цис-конфигурация, другому же — транс-:
При отнятии воды от цис-терпина, кроме предельной жидкой окиси — цинеола, кип. при 176°, образуется еще ряд непредельных спиртов — ментенолов и два терпена — терпинолен и дипентен (см. дальше). Присоединение галоидов к пинену в силу его изомеризационной способности протекает ненормально. Путем довольно сложных манипуляций при действии брома получается кристаллический С10Н16Br2 с темп. плавл. 169°—170°. Это же соединение образуется из пинена при обработке его бромноватистой кислотой; оно, однако, не представляет бромистого пинена как по способу его образования, так и по тому, что при отнятия брома цинковой пылью получается не пинен, а новый Т. (трициклен). С10Н16С12, образующийся из пинена под влиянием хлорноватистой кислоты, плавится при 165—168° и вполне аналогичен C10H16Br2. Присоединением водных остатков к пинену при окислении его влажным кислородом на солнечном свету образуются кристаллы непредельн. гликола — собрерола С10Н18О2, строения:
Собреролы, полученные из деятельного пинена, вращают плоскость поляризации и плав. при 150°; недеятельная же смесь обоих изомеров — при 131°; кип. при 270°. Собрерол оказал немалую услугу в установлении строения пинена. Присоединение хлористого нитрозила к пинену ведет к образованно биснитрозильного продукта состава С10Н16Cl—N2O2—C10H16Cl, плав. при 103°. При обработке хлоронитрозопродукта спиртовой едкой щелочью образуется нитрозопинен — С10H15NO (плав. 132°); последний под влиянием спиртовой;соляной кислоты переходит в хлоргидрат карвоксима — C10H15ClNOH
Хлоронитрозопинен под влиянием анилина, как упомянуто выше, теряет элементы хлористого нитрозила, при чем регенерирует пинен. Присоединение хлорноватистой кислоты дало целый ряд интересных продуктов; так, получен кристаллич. продукт C10H18Cl2O2, плав. при 136—137°, строение которого:
Из него при отнятии хлора нормально образуется собрерол, а заменой хлора водными остатками — собреритрит, четырехтомный спирт ментан-1,2,6,8-тетраол, плавящ. при 193—194°. При обработке продуктов реакций щелочью получены два кристаллич. соединения состава С10Н17О2Cl; одно с темп. пл. 131—132°, другое — 104—105°; первое является оптически деятельным изомером, вращающим в обратном направлении, чем исходный пинен, [α]D = +88°23′, второе — рацемической смесью обоих; кроме того, получена двуокись С10Н6О2. Достойно внимания, что кристаллический хлоргидрин C10H17ClO2 не способен ни при каких условиях переходить в двуокись, откуда следует, что он не должен быть рассматриваем как промежуточный продукт при образовании последней. Строение этих соединений еще не установлено, образование в этих же условиях продукта C10H16Cl2 было уже упомянуто выше. Реакции окисления по отношению к пинену были применены очень давно, но только теперь, когда строение терпениловой (см.) и теребиновой (см.) кислот установлено, когда известно образование из пинена цимола под влиянием кислот и, наконец, когда применены нейтральные и щелочные окислители, били получены данные, давшие возможность окончательно установить строение пинена. При окислении было получено много разных продуктов и кислот, и мы ограничимся лишь указанием формулы и названия главнейших. Так, при окислении марганцевокалиевой солью получены:
Две последние кислоты под влиянием щелочного раствора брома переходят в соответствующие двухосновные кислоты.
Пиноилмуравьиная кислота указанной выше формулы известна лишь в солях и иных производных, в свободном же состоянии она является в виде лактона.
Кроме указанных кислот, изучена еще кислота С10Н16О3, названная нопиновой; она представляет α-оксикислоту и, как таковая, под влиянием перекиси свинца переходит в кетон С9Н4О — нопинон:
Образование последних двух продуктов, а также нопинолгликола, образующегося в числе других упомянутых выше веществ при обработке щелочью продуктов присоединения к пинену хлорноватистой кислоты, делает весьма вероятным предположение, что к обыкн. пинену постоянно примешан его изомер нопинен с этиленной связью вне кольца:![]() (Т. и их производные этой формулы называют псевдоформами). Сохраняющееся во всех приведенных производных диметилтетраметиленное кольцо Бэйер предлагает назвать «пицеанным» кольцом. Образование кислот теребиновой и терпениловой под влиянием кислых окислителей также легко объясняется, если только принять во внимание, что, как уже было указано выше, под влиянием кислот гидратируется пицеанное кольцо (образование дихлоргидрата, терпина, терпинеола и проч.).
(Т. и их производные этой формулы называют псевдоформами). Сохраняющееся во всех приведенных производных диметилтетраметиленное кольцо Бэйер предлагает назвать «пицеанным» кольцом. Образование кислот теребиновой и терпениловой под влиянием кислых окислителей также легко объясняется, если только принять во внимание, что, как уже было указано выше, под влиянием кислот гидратируется пицеанное кольцо (образование дихлоргидрата, терпина, терпинеола и проч.).
Камфен, Δ2-3-метилен-2-диметилбицикло-[1,2,2]-гептен (?)
(Вагнер)
Камфен в природе встречается в скипидаре из «Pinus sibirica», a также и в некоторых др. эфирных маслах, как-то: Ol. Citronell., Ol. Zingiber., Ol. Camphor. и проч. Получают камфен искусственно или из монохлоргидрата пинена отнятием от него HCl, или же в более чистом состоянии из изоборнеола либо борнеола (С10Н17ОН), отщепляя от них воду хлористым цинком, серной кислотой и пр.; при этих реакциях, кроме дегидратации, происходит и изомеризация углеродного ядра, так как, судя по всем данным, в камфене имеется иной углеродный скелет, чем в борнеоле и монохлоргидрате пинена. Камфен плав. около 50° и кип. при 160—161°. Запах его приятный, слегка камфорный; d48 = 0,850; камфен известен в трех оптич. видоизменениях: правый, левый и недеятельный; максимальное вращение: [α]D = —80°37′. Он реагирует как соединение с одной этиленной связью, хотя все реакции присоединения, характеризующие этиленную связь, протекают по отношению к камфену сравнительно медленно и не всегда правильно; в пользу одной, однако, этиленной связи говорит и коэфф. преломления при 48° nc = 1,4555. Вычисленная молекулярная рефракция вполне совпадает с рассчитанной на одну этиленную связь. Камфен не способен изомеризоваться ни в один из известных Т.; под влиянием, однако, крепкой серной кислоты разлагается сравнительно легко, фосфорный ангидрид переводит его в масло, содержащее цимол, при нагревании при 250—270° переходит в жидкость, в которой находятся продукты с более низкой и более высокой точкой кипения, нежели исходный камфен и проч. На воздухе не изменяется и не осмоляется. Строение самого камфена еще не установлено вполне, и его необходимо признать существенно отличным от строения камфоры и пр. многочисленных продуктов, связанных переходами с последней. В рассуждениях о строении камфоры (см.), обладающей тем же ядром, что и остальные главнейшие представители камфорного ряда, одно из первых мест должно занимать получение глубоким окислением камфоры триметилянтарной кислоты:
Это же самое ядро находится в борнилене (см. дальше), открытом всего год тому назад и непосредственно отвечающем борнеолу, камфоре и пр. продуктам этого ряда. Присоединение HCl (1 ч-ца) к камфену дает хлоргидрат, плав. при 159° и отвечающий, по-видимому, не камфену, а борнилену; галоидгидрат, получаемый из правовращающего камфена, вращает влево, из левого камфена — вправо. О строении этих гидратов см. ниже. Отнятие HCl от упомянутых хлоргидратов происходит легко даже при простом нагревании их с водой при 100° (отличие от монохлоргидрата пинена), при этом получается обыкновенно чистый камфен, образование которого нужно считать опять-таки сопровождающимся изомерацией; в некоторых, однако, особых условиях удается получить непосредственный продукт — борнилен. Присоединение воды к камфену дает следующую картину: из пинена под влиянием органических кислот, как уже было указано, образуется между прочими продуктами отвечающий камфоре предельный спирт — борнеол С10Н17ОН; из камфена в подобных же условиях образуется также предельный спирт, изоборнеол С10Н17ОН, отличающийся, однако, от борнеола своей способностью легко терять элементы воды и регенерировать при этом камфен (аналогия указанных свойств спиртов со свойствами хлоргидратов, получаемых подобными же путями!); и здесь при соблюдении некоторых условий удается получить прямой продукт дегидратации — борнилен. Борнеол и изоборнеол при окислении переходят в один и тот же соответственный кетон — камфору, равно как смесь их обоих получается при восстановлении камфоры. Борнеол и изоборнеол, след., представляют спирты вторичные и, переходя в тот же самый кетон — камфору, должны являться изомерами лишь стереохимическими. Оптические свойства спиртов, получаемых из камфена, повторяют явление, наблюдаемое при хлоргидратах, т. е. правый камфен дает левовращающий спирт, левый углеводород — правый спирт. Борнеол представляет собой кристаллы, плав. при 203—204°, кип. при 217°; изоборнеол плав. при 217°, темп. же кип. не поддается определению вследствие громадной сублимационной способности продукта; уксусный эфир борнеола кристалличен и плавится при 29°, изоборнеола — жидок. Оба спирта встречаются в природе и известны под именем борнейской камфоры (см.), в которой заключается около 80% борнеола и 20% изоборнеола. Борнеол не обменивает на холоду водного остатка на хлор под влиянием хлористого водорода, а лишь при действии пятихлористого фосфора, тогда как изоборнеол легко образует хлоргидрат при пропускании хлористого водорода в спиртовой раствор изоборнеола. При тщательном сравнении хлористого изоборнила с хлоргидратом камфена они оказались вполне тождественными. Из камфена, следовательно, образуются лишь правый и левый хлористые изоборнилы. Хлористый борнил получается через борнеол; он оказывается тождественным с хлоргидратом пинена (Вагнер). Формулы строения обоих спиртов:
и отвечающих им хлоргидринов одинаковы и должны различаться между собой лишь пространственным расположением атомов. Присоединение галоидов к камфену протекает сложно; при сильном охлаждении образуются кристаллы бромистого камфена С10H16Br2, плавящиеся при 90°; вместе с ними, однако, образуется и побочный продукт С10Н15Br, который пока ближе не исследован. Кроме бромюра, известен продукт C10H16Cl2, плавящийся при 155° и образующийся, если хлорировать хлоргидрат камфена; легче получается тот же хлорюр, если обрабатывать камфору пятихлористым фосфором, и этот путь указывает, что в описываемом хлорюре углеродный скелет камфорный и оба хлора стоят при одном и том же углероде. Вообще этот хлорюр непрочен и легко отщепляет хлороводород. Присоединение водных остатков к камфену, след., получение камфенгликола C10H18O2 реализовано окислением камфена марганцово-калиевой солью; при этом камфен из борнеола образует гликол с темп. плав. 192,5°—194°, а камфен из изоборнеола — с темп. плав. 197,0—198,5°. Строение гликола надо считать отвечающим формуле камфена, след., не отвечающим конфигурации соединений камфорной группы, так как при дегидратации он образует не кетон — камфору, а альдегид, что согласуется с формулой гликола, долженствующего отвечать камфену. Присоединение хлорноватистой кислоты по отношению к камфену протекает также не совсем правильно; из продуктов реакции удается отгонкой выделить соединение состава C10H15Cl, которое представляет, по-видимому смесь; кроме того, образуется соединение C10H16Cl2, строение которого еще не установлено, равно как получается еще окись C10H16O, которая весьма легко, даже при простом взбалтывании с кислой сернисто-натриевой солью, изомеризуется в альдегид.
Окисление камфена не дало каких-либо особенно ценных данных, и все более существенные результаты, проливающие свет на строение соединений камфорной группы, получены были (главным образом — Бредтом) при окислении камфоры (см.); теперь, когда уже известно, что скелеты камфена и камфоры разные, такой результат вполне понятен. В общем нужно указать, что имеется немало данных в пользу предположения, что продажный камфен, подобно некоторым другим Т., представляет смесь нескольких, (по меньшей мере двух) относительно весьма близких изомеров, увеличивающих разнообразие образующихся при разных реакциях продуктов, равно как понижающих количественный выход каждого из них.
Из других реакций, важных для соединений камфорной группы, укажем, что под влиянием некоторых агентов (Р2О5 и др.) камфора переходит в парацимол, что указывает на параположение метильной и освобождающейся изопропильной групп. Далее, при действии на камфору крепкой серной кислоты (при 105—110° С) образуется продукт, в котором найдено до 25% карвенона (см. далее). Наконец, не особенно давно реализирован переход от йодгидрина борнеола (йодгидрата пинена) при обработке его уксусно-серебряной солью с уксусной кислотой в уксусный эфир терпинеола (Δ1-ментен-8-ола), что устанавливает близкую связь конфигурации соединений камфорной группы с конфигурацией терпинеола и, следовательно, еще раз подтверждает правильность формул Бредта. При номенклатуре производных камфорной группы, подобно тому, как Бэйер для пиненного кольца предложил название «пицеан», Бредт, считая свои формулы в камфорном ряду установленными, предложил для камфорного, а следовательно, и для борниленного и т. п. кольца — триметилпентаметиленного — название «камфоцеан».
Борнилен. Δ2-1-метил-7-диметилбицикло-(1,2,2]-гептен:
Углеводород этот, значение которого для разъяснения строения камфена весьма велико, получен искусственно лишь год тому назад при обработке йодгидрата пинена в особых условиях спиртовым едким кали (Вагнер и Брикнер) и при сухой перегонке метилового борнилксантогенового эфира C10H18OCSSCH3 (Чугаев). Борнилен плавится при 98° и кип. при 150°. При окислении почти количественно переходит в камфорную кислоту, что вполне определяет его строение и приводит к заключению, что он-то и есть настоящий Т., отвечающий камфоре и борнеолу. Образуется борнилен ксантогеновым способом как из борнеола, так и из изоборнеола, чем подтверждает тождество их структуры. Присоединяя HCl, образует новый хлоргидрат, плав. при 140—141°; при отнятии галоидоводорода дает новый Т., кипящий при темп. обыкновенного камфена, плавящийся выше — при 64—65°. Новый Т. при настаивании с уксусной и серной кислотой гидратируется и переходит в новый спирт, отвечающий хлоргидрату; плавится при темп. борнеола; уксусный эфир его не кристалличен; при окислении образует кетон. Во всех этих производных предполагается камфоцеанное кольцо. Открытие борнилена представляется весьма важным с теоретической точки зрения, так как теперь лишь можно утверждать, что ядро камфена не одинаково с ядром камфоры и проч. продуктов камфорной группы; углеводородом же, отвечающим этой группе, является борнилен.
Фенхен получается дегидратацией фенхилового спирта; последний же образуется при восстановлении входящего в состав укропного и анисового масла кетона — фенхона С10Н16О, аналогичного камфоре; кроме того, фенхиловый алкоголь образуется, как уже было упомянуто, в числе продуктов гидратации пинена. Фенхен — углеводород с одной этиленной связью, след., соединение бициклическое. Строение его еще не установлено. Темп. кип, от 140—141° до 158—160°, уд. в. 0,8385—0,864, [α]D = от —55° до +43°; запах напоминает камфен.
Туйен (танацетен), Δ1-метил-1-изопропилбицикло-[0,1,3]-гексен, получен в самое недавнее время искусственно ксантогеновым методом из туйилового спирта; последний получается при восстановлении кетона — туйона (танацетона), входящего в состав многих масел, как-то: Ol. Thujae, Ol. Tanaceti, Ol. Absynthii, Ol. Salviae и др. Полученный таким образом Т. кип. при 151,5—152,5°, уд. в. 0,8275, nd = 1,45042 (20°); вычисленное отсюда молек. преломление 44,21 превышает теоретическое 43,54, но это же наблюдается и для туйилового алкоголя и для туйона и обусловливается, вероятно, особой группировкой углеродного ядра. Туйен весьма легко окисляется на воздухе и, вообще, весьма непрочен.
2) Т. с двумя этиленными связями (моноциклические). Лимонен, Δ1,8-ментадиен:
Подобно пинену, весьма распространен и является главною составною частью в маслах лимонном, померанцевом, бергамотном, тминном, в меньших количествах в масле сосновых игл, в русском мятном масле и пр. Наиболее чистый лимонен получается из масла померанцевых корок тщательной фракционировкой; встречается как в виде оптически деятельных изомеров, так и в виде недеятельной смеси, носящей название — дипентен. При исследовании разных эфирных масел выделяемый из них лимонен прежде считали за разные изомеры, и потому тот же Т. оказался носящим разные названия, как то: геспериден, цитрен, кайепутен, цинен, карвен, уже знакомый нам дипентен и пр. Лишь в 1884 г. исследованиями Валлаха было установлено тождество всех этих Т. — Лимонен представляет жидкость с приятным лимонным запахом, кип. при 170—176°; d2020 = 0,845; [α]D = +106,8° и —105°. Для наиболее чистого лимонена, полученного из бромюра, найдены: темп. кип. 177,5°; d2020 = 0,8441; [α]D = +125°36′. Недеятельный лимонен — дипентен — является продуктом изомеризации, деполимеризации и дегидратации многих Т. и их производных; однако и сам он способен при продолжительном кипячении с разведенными минеральными кислотами изомеризоваться в весьма постоянный Т. — терпинен. Лимонен реагирует как соединение с двумя этиленными связями, представляет соединение моноциклическое, и строение его следует считать прочно установленным на основании изучения его переходов и продуктов окисления. Главнейшие из его производных образуются при следующих реакциях. Присоединение галоидоводорода. Если насыщение хлористым водородом производить в сероуглероде при условии соблюдения абсолютного отсутствии влаги, то удается получить продукт присоединения одной лишь частицы HCl, причем образуется жидкий, оптически деятельный продукт, которого [α]D = ±40; отсюда следует, что первая частица галоидоводорода присоединяется к двойной связи не в кольце, а в боковой цепи, так как в таком лишь случае сохраняется асимметрический углерод. Относительно монохлоргидрата лимонена следует заметить, что по отношению к сухому хлористому водороду он содержится как соединение предельное, присоединяет, однако, легко галоиды, хлористый нитрозил и пр. Если присоединение галоидоводорода вести не при полном отсутствии влаги, то как моногалоидгидрат лимонена, так и сам он переходят в дигалоидгидрат лимонена, называемый вследствие утраты оптической деятельности дигалоидгидратом дипентена (см. выше при пинене). Продуктов присоединения воды к лимонену известно два; один из них реализуется через монохлоргидрат лимонена обменом в последнем галоида на водный остаток, при чем получается терпинеол, и если монохлоргидрат был оптически деятельный, то и терпинеол получается деятельный. Продуктом присоединения двух частиц воды является терпин, который образуется из лимонена в тех же условиях, как и из пинена. Присоединение галоидов к лимонену (дипентену) имело весьма важное значение при разработке всего терпенного отдела; изучение и исследование образующихся продуктов было, можно сказать, пробитием бреши в отделе Т. и эфирных масел. Лимонен присоединяет 4 ат. брома, и образующийся при этом тетрабромюр C10H16Br4 обладает разными свойствами, смотря по тому, получен ли он из деятельного лимонена или из недеятельного (дипентена); тетрабромюры из деятельного углеводорода и сами деятельны, [α]D = +73,45°, плавятся они при 104—105°; из дипентена же недеятелен и плавится при 125—126°. Если смешать правый и левый изомеры с темп. пл. 104—105°, то получается недеятельный продукт с темп. пл. 125—126°. При отнятии брома при помощи спиртовой щелочи отпадают 2 атома брома в виде бромоводорода, третий бром обменивается на спиртовой остаток (—OR), и четвертый бром не удаляется совсем; подобное содержание тетрабромюра как нельзя лучше согласуется с строением тетрабромлимонена:
Строение образующегося продукта подтверждается еще тем, что по замещении брома водородом и окислении продукта хромовой кислотой получается карвон, кетон строения:
Из продуктов присоединения водных остатков укажем на получение окислением лимонена марганцово-калиевой солью четырехатомного спирта, лимонэтрита, представляющего кристаллы, трудно растворимые в эфире, легко — в воде, сладковатого вкуса, плавящиеся при 191,5—192° и оптически деятельные. Кроме эритрита, известен отвечающий дипентену непредельный гликол Δ8-ментен-1,2-диол, получаемый, впрочем, окольным путем. Плавится этот гликол при 63—64° и перегоняется при 259—260° (754 мм); оптически недеятелен; при окислении его марганцово-калиевой солью образуется недеятельный же эритрит, представляющий дипентенэтрит; плавится он при 168,5—169,5° и в общем повторяет все свойства лимонэтрита. Этот же эритрит получен и непосредственно окислением дипентена. Присоединение хлористого нитрозила к лимонену представляется весьма важной и интересной реакцией; присоединяется всего лишь одна частица хлористого нитрозила, и первые изучения образующихся продуктов дали весьма ценные указания относительно связи лимоненной конфигурации с таковой же карвонного ряда; реакция эта интересна и потому, что из лимоненов получены все возможные изомеры хлоронитрозопродуктов, принимая во внимание и оптические, и стереохимические соображения; так, из правого лимонена получены два хлоронитрозопродукта цис- и транс-, столько же из левого изомера, равно как дипентен тоже дает два: α-хлоронитрозолимонен, плав. при 103°—104°; [α]D = +314,8; β-продукт плав. при 100° и [α]D = +242,2; α- и β-дипентенхлоронитрозопродукты получаются как непосредственно из дипентена, так и смешением соответственных изомеров из лимоненов. Следует еще указать, что из лимонена образуются бис-нитрозильные производные; во всех, однако, превращениях эти продукты содержатся как мономеры. Под влиянием спиртового едкого кали α- и β-продукты каждого оптического изомера образуют тот же самый правый или левый карвоксим с темп. плав. 72°, a α- и β-изомеры дипентена образуют один и тот же недеятельный карвоксим с темп. плав. 93°, Если к карвоксиму присоединить хлористый водород и затем отнять его, то происходит изомеризация; двойная связь передвигается в ядро и получается оксим кетона, неспособного к существованию в свободном состоянии; при омылении он сразу переходит в карвакрол:
Реакции окисления лимонена (и карвона) в последнее время окончательно подтвердили правильность предложенной Вагнером формулы лимонена (карвона). Так, при окислении марганцовокалиевой солью была получена окситерпениловая кислота, которой Вагнер и приписал следующее строение:
Кроме того, получается также непредельная кислота состава терпениловой, которой приписывают строение:
и, наконец, вскоре после этих исследований был получен из дигидрокарвеола (см. дальше) кетон состава, вполне подтверждающего нахождение в лимонене и карвоне пропенильной группы:
Бромирование лимонена и переведение его в парацимол было уже упомянуто выше. Из прочих реакций, дающих ряд интересных производных, укажем, что если, напр., карвон восстановят натрием в алкоголе, то он присоединяет 4Н и переходит в спирт — дигидрокарвеол:
Больше 4Н непосредственно карвон присоединять не способен; если же, напр., восстановление вести цинковой пылью в щелочном растворе или уксусной кислоте, то присоединяются всего лишь 2Н; кетонная группа при этом почти не восстановляется и получается соответств. кетон дигидрокарвон, который прежде получали окислением хромовой кислотой дигидрокарвеола. Чтобы получить продукт полного восстановления, к уксусному эфиру дигидрокарвеола присоединяют HJ и полученный продукт обрабатывают цинковой пылью в уксусном растворе; при этом образуется продукт полного восстановления — С10H20О, тетрагидрокарвеол — карвоментол, который можно окислением хромовой кислотой перевести в тетрагидрокарвон — карвоментон (см дальше), равно как отнятием воды в непредельный углеводород С10Н18 — карвоментен:
Терпинолен, Δ1,4(8)-ментадиен им. строение:
получается лишь искусственно, напр. при кипячении терпингидрата, терпинеола или цинеола с разведенными серной или фосфорной кислотами. Наиболее чистый продукт образуется, если на дигидробромистый дипентен действовать бромом, продукт восстановлять цинковой пылью в уксусной кислоте и полученный непредельный третичный уксусный эфир:
перегнать с хинолином; при этом отщепляется частица уксусной кислоты и образуется терпинолен. Чистый Т. представляет жидкость оптически недеятельную, кипит при 183°—185° и при этом легко изменяется и уплотняется. Он реагирует как соединение с двумя этиленными связями, сам по себе крайне нестоек и при нагревании, напр., с кислотами изомеризуется в терпинен. Галоидоводороды присоединяются, образуя более стойкий дигалоидгидрат дипентена. Отщепление галоидоводорода ведет к образованию дипентена. Галоиды присоединяются в количестве двух частиц, хотя можно получить и продукты присоединения одной частицы; так, известен двубромистый терпинолен, образующийся при недостаточном количестве брома и представляющий кристаллич. тело с т. пл. 69°—70°. Четырехбромистый продукт представляет кристаллы с т. пл. 116°, непостоянные при сохранении. При восстановлении тетрабромюра цинковой пылью в уксусной кислоте регенерируется химически чистый терпинолен. Продукт присоединения хлористого нитрозила получается в жидком виде характерного синего цвета, что указывает на присутствие в терпинолене группировки: >С=С<. Нитрозит (продукт присоединения N2O3) получается кристалличный, плав. при 155°. Из реакций окисления можно указать, что терпинолен в противоположность карвестрену и терпинену сравнительно трудно окисляется Бекмановской хромовой смесью на холоду, почему и можно пользоваться этой реакцией для очищения его от указанных примесей.
Сильвестрен и карвестрен Δ-1,5-ментадиен (мета).
(Гинзберг)
Оба Т. находятся, судя по всем данным, в таком же отношении друг к другу, как деятельный лимонен к недеятельному дипентену. Сильвестрен давно был открыт в шведском скипидаре, а затем в русском, равно как и в нек. др. В чистом виде его получают переведением из скипидара в дихлоргидрат, к которому обыкновенно примешан и дихлоргидрат дипентена; от последнего его освобождают довольно кропотливой перекристаллизацией и обработкой алкоголем, после чего, наконец, от дихлоргидрата отщепляют хлороводород. Чистый Сильвестрен жидок, с приятным лимонным запахом, кип. при 176°—177°; d160 = 0,851; оптич. деятелен, [α]D = +66,32°. Карвестрен представляет недеятельный углеводород со свойствами сильвестрена, получается искусственно, причем исходным материалом служит карон (см. дальше); путь образования его довольно сложен. Сильвестрен представляет один из наиболее прочных Т. и при нагревании до 250° или под влиянием спиртовой серной кислоты он полимеризуется лишь отчасти, при этом, однако, не изомеризуясь. Если к раствору сильвестрена и карвестрена в уксусном ангидриде прибавить каплю серной кислоты, то вся жидкость окрашивается в интенсивный синий цвет (характерная качественная реакция). Другие Т. дают в этих условиях красное либо желтое окрашивание (эту же реакцию воспроизводит дигидробензол). В реакциях присоединения оба Т. содержатся как соединения с двумя этиленными связями, и из их производных известны дигалоидгидраты и тетрабромпродукты. Характерно, что все продукты присоединения сильвестрена оптически деятельны; так, напр., дихлоргидрат [α]D = +18,99°; т. пл. 72°; четырехбромистый сильвестрен пл. при 135°—136°; [α]D = +33,74°. Явление это находит объяснение в формуле Т., из которой видно, что во всех продуктах сохраняются асимметрические атомы углерода. Сама же формула (метаряда) установлена путем глубокого обромления и последующего превращения в цимол, который и для сильвестрена, и для карвестрена оказался метаряда. Бэйер приписывает карвестрену (и сильвестрену) формулу металимонена:
Но формула эта не согласуется с некоторыми его свойствами, тогда как приведенная выше весьма удовлетворительно объясняет неспособность такого Т., в противоположность лимонену, изомеризоваться; способность воспроизводить характерную цветовую реакцию дигидробензола и, наконец, теснее сближает его с весьма схожим с ним — терпиненом, который, между прочим, подобно сильвестрену, неспособен изомеризоваться и весьма легко, даже на холоду, окисляется Бекмановской хромовой смесью.
Терпинен. Этот Т. найден в одном только эфирном масле, кардамонном. Искусственно он получается как конечный продукт дегидратации и изомеризации дипентена, фелландрена, терпина, цинеола, дигидрокарвеола и проч. Во вполне чистом виде его получить еще не удалось, так как в зависимости от реакции образования к нему всегда примешаны или другие Т., или цимол; наиболее чистый продукт кипит при 179—181°; запах напоминает цимол; является наиболее постоянным Т. и под влиянием, напр., спиртовой серной кислоты способен лишь уплотняться, но не изомеризоваться; с другой, однако, стороны терпинен весьма легко, на холоду уже, окисляется хромовой смесью. С галоидоводородами реагирует как соединение с двумя этиленными связями; продукты получаются жидкие. Характерным является, что при этом всегда образуется некоторое количество дигалоидгидратов дипентена. Это наблюдение в связи с неспособностью терпинена изомеризоваться указывает, что обе этиленные связи находятся в кольце и, очевидно, при С1 и С4. С бромом получен дибромопродукт, но тоже не кристалличный. Кристалличен лишь нитрозит; из него получено много нитроламинных и иных производных.
Фелландрен является составною частью довольно большого числа эфирных масел, причем впервые он был найден в масле водяного укропа (Phellandrum aquaticum), откуда и произошло его название; он оптически деятелен, причем правый встречается в разных укропных маслах и масле элеми, левый в эвкалиптовом (из Eucalyptus Amygdalina), масле сосновых игл и пр. Легко изомеризуется, и поэтому фракционировать масла для его выделения приходится под уменьшенным давлением; для получения его в чистом виде еще нет метода, почему и не установлены с точностью его физические свойства; наиболее богатая фелландреном фракция (80%), имевшаяся в руках исследователей, кипела при 171°—172°; d100 = 8558; [α]D = + 17,691°. Присоединение к фелландрену бромистого водорода протекает довольно энергично, продукт реакции получается жидкий, и если от него отщеплять элементы галоидоводорода, то образуется дипентен; при обработке того же бромгидрина спиртовой серной кислотой получается терпинен. С бромом получен жидкий дибромюр, который при обработке спиртовой щелочью образует цимол. Кристаллические продукты из фелландрена получены при обработке его азотистой кислотой, при чем, однако, образуется не нитрозит, а нитронитрит, в котором находится группа
нитрит, полученный из правого углеводорода, вращает сам влево, [α]D = —183,5°, а из левого фелландрена — вправо; смесь обоих нитритов дает недеятельный изомер с тою же т. пл. 103—104°. При восстановлении нитрита водородом получается фелландрендиамин C10H20N2; при восстановлении же металлич. натрием в спирте образуются карвонные (лимоненные) производные. Основываясь на присутствии оптической деятельности как в самом фелландрене, так и в его производных, равно как на связи его с дипентеном, можно считать наиболее вероятной для него приводимую рядом формулу строения.
3) Главнейшие терпенные производные состава С10, образующиеся из Т. не непосредственно, а окольными путями. Ментан C10H20
представляет конечный продукт восстановления весьма многих терпенных соединений; он образуется при нагревании, напр., большинства из них с йодистым водородом и красным фосфором, при восстановлении галоидопроизводных водородом в момент выделения и проч. Все известные ментаны (пара-ряда) можно свести лишь к двум продуктам с разными свойствами; ментан, получаемый, напр., из пинена, хлоргидрата пинена и т. п., кип. при 162°, и продукт из терпингидрата, ментола и пр. — при 168—169°; оба они имеют одинаковый уд. в. d°0 = 0,8067. Представляют они цистрансизомеры. Образование из терпингидрата продукта с тем. кип. 168°—169° указывает, что он представляет трансментан, и второй продукт, след., цисментан. По отношению к разным реагентам, как то: азотная кислота, азотная с серной, марганцово-калиевая соль и др., ментан оказывается весьма прочным; бром действует металептически, получаются, однако, некристаллизующиеся продукты. Кроме этих изомеров, известен еще, вероятно, структурный изомер, ментан из фенхонных производных, которые, как известно (см. выше фенхен), переходят в метацимол; вероятно, и этот ментан представляет метаметилизопропилгексаметилен; в общем, он повторяет свойства описанных выше ментанов и относится иначе только к брому, с которым образует с небольшим выходом кристаллический бромюр, плавящ. выше 200°; бромюр, к сожалению, не анализирован.
Ментанолы, ментаноны и ментены: С10Н20О; C10H18O; C10H18. Обыкновенный ментол (см. это сл. и Камфора) — ментан-3-ол — плав. при 42°, кип. 212°, оптич. деятелен, [α]D = —59°6′. При окислении хромовой смесью он образует кетон — ментон, а при более глубоком окислении марганцово-калиевой солью — β-метиладипиновую кислоту, откуда следует для него формула:
При дегидратации он образует углеводород ментен (темп. кип. 167,5°) с одной двойной связью Δ3, положение которой установлено окислением углеводорода. Тетрагидрокарвеол — ментан-2-ол — представляет следующий возможный вторичный ментанол; получается он восстановлением карвона (см. выше при лимонене), жидок, кип. при 220°; d203 = 0,90. Формула его:
При окислении хромовой смесью он образует кетон карвоментон (кип. 222°—223°); последний при дальнейшем окислении образует изопропилянтарную кислоту, подтверждающую строение его. При дегидратации этот ментанол образует углеводород карвоментен с двойной связью Δ1 (кип. 174,5°). Третичный ментол — ментан-4-ол — образуется, если к Δ3-ментену присоединить йодистый водород и обменять йод на водный остаток; представляет жидкость со слабым мятным запахом; при обыкн. давл. не перегоняется без разложения, при 20 мм кип. между 97—101°. К хромовой смеси относится как третичный спирт, равно как легко теряет воду, образуя тот же Δ3-ментен. Третичный карвоментол — ментан-1-ол — получается аналогично ментолу; он обладает слабым запахом, еще менее прочен, чем тот, кип. при 17 мм между 96° и 100°; к хромовой смеси относится как третичный спирт; теряя воду, регенерирует карвоментен — Δ1. Терпин — ментан-1.8-диол — был рассмотрен при пинене. Ментенгликол — ментан-3.4-диол — образуется из ментена при окислении его марганцово-калиевой солью.
Ментенолы C10Η18Ο. Их известно три; два из них третичные, один вторичный, кроме того, мы рассмотрим один ментендиол (C10H18O2) — собрерол. Обыкн. терпинеол — Δ1-ментен-8-ол, плав. при 35°, встречается в природе в масле Erigeron Canadense и, как уксусный эфир, в кайепутовом. Этот терпинеол наиболее изучен; известны следующие его производные: дибромтерпинеол C10H17Br2OH (некристалличен), от которого известны переходы к пинолу, собреролу и эфиру карвеола (см. дальше); хлоронитрозопродукт, из которого получены разнообразные нитроламины, оксимы и проч. производные и, наконец, довольно подробно изучены продукты окисления его марганцово-калиевой солью; порядок образования их следующий:
Ментан-1,2,8-триол при некоторых условиях образуется из терпинеола в теоретическом количестве, он кристалличен, плав. при 121°—122° и кип. выше 300°. При дальнейшем окислении образуется, также количественно, кетолактон, который плав. при 62°—63°, кип. при 330°; оксим его плав. при 77°, семикарбазон — при 200°. Кетолактон при дальнейшем окислении щелочным раствором брома образует гомотерпениловую кислоту
при окислении же марганцовой солью или хромовой кислотой — терпениловую (см.) и уксусную. Известен оптич. деятельный изомер ментен-8-ола, которого [α]D = —117,5°. Δ4(8)-ментен-1-ол образуется в условиях, указанных при терпинолене; полученный уксусный эфир омыляют и получают ментенол в чистом виде; плав. он при 69°—70°; дает с бромом кристаллич. продукт С10Н17Вr2ОН (т. пл. 114°—115°), с бромистым водородом — дибромгидрин дипентена, с хлористым нитрозилом — синий продукт C10H17ClNO—OH, плав. при 82°. При окислении марганцовой солью образуется ментан-1.4.8-триол, плав. с кристаллизационной водой при 95°—96°, без крист. воды — 110°—112°. Δ8-ментен-2-ол, вторичный спирт дигидрокарвеол, жидок, запахом напоминает обыкн. терпинеол, кип. при 224°—225°, d20° = 0,927; при его окислении получены были важные данные для суждения о строении карвонных производных и лимонена; продукты эти следующие:
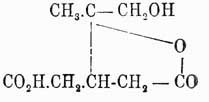
Полученный кетон при окислении щелочным раствором брома окисляется в соответственную кислоту, строение которой подтверждено ее способностью переходить в метаоксипаратолуиловую кислоту. Есть, наконец, основания предполагать существование еще одного ментенола, Δ8-ментен-1-ол, который имеется, вероятно, в жидком терпинеоле Шиммеля. Собрерол — Δ6(1)-ментен-2.8-диол — является, подобно терпину, производным как пиненного ряда, так и лимоненного; значение его, однако, несравненно важнее значения терпина, так как он представляет соединение непредельное, что, с одной стороны, дало возможность сравнительно легко установить его строение, с другой — получить целый ряд производных и разъяснить механизм многих переходов. Из пинена собрерол получается непосредственно раскрытием тетраметиленного кольца, из лимонена — через терпинеол. Из пинена (деятельного) получается деятельный собрерол, из лимонена — недеятельный; т. пл. деят. 150°, недеят. — 131°; т. кип. 271° (749 мм). Из производных собрерола главнейшие след.: при окислении его марганцово-калиевой солью получается предельный четырехатомный спирт — ментан-1.2.6.8-тетраол (темп. пл. 156°), что вполне подтверждает непредельность и гликольную натуру собрерола. При дегидратации собрерола образуется на счет водных остатков окись γ-ряда — пинол (см. дальше); ход реакции виден на схемах:
При присоединении брома к собреролу образуется бромюр, плав. при 131° (темп. пл. исходного вещества!); если на этот бромюр действовать едкою щелочью, то он теряет 2HBr и образует предельную α-γ-двуокись, переходящую при гидратации в пинолгликол:
Ментеноны С10Н16О. Дигидракарвон — Δ8-ментен-2-он — получается при окислении дигидрокарвеола хромовой кислотой; т. к. 221°—222°; d190 = 0,928; из его производных известны: продукты присоединения Br, Cl, HBr, оксим, семикарбазон и проч. Карвенон — Δ4-ментен-2-он — получается, если дигидрокарвон кипятить с разведенными кислотами; реакция представляется аналогичной изомеризации лимонена в терпинен; карвенон является, подобно терпинену в углеводородном ряду, конечным продуктом изомеризации кетонов C10H16Ο, в которых кислород находится при С2; есть основания предполагать в нем таутомерное соединение и вероятное строение его:
Карвотанацетон — Δб-ментен-2-он — получается, если туйон — кетон, входящий в состав масла туи, — нагревать при 280°; туйон (танацетон) представляет соединение без этиленной связи, карвотанацетон же — соединение непредельное; кип. он при 228°; d17 = 0,9373. При восстановлении карвотанацетон присоединяет 4Н и переходит в тетрагидрокарвеол, откуда следует положение кислорода при С2; положение этиленной связи вполне еще не установлено. Пулегон — Δ4(8)-ментен-3-он — встречается в природе в эф. маслах Mentha pulegium и Hedeoma pulegoldes, представляет жидкость оптически деятельную, кип. при 221°—222°; d20 = 0,9323; [α]D = +22,94°; реагирует как соединение с одной этиленной связью, образуя хлористоводородный пулегон (темп. пл. 24°—25°), и при восстановлении переходит в ментон, что проливает свет на его конституцию. С гидроксиламином образует два соединения, из которых одно богаче элементами воды; нормальный оксим плав. при 118°—119°, другой — при 157°. Сильно поглощает фиолетовые лучи, и Валлах ставит это свойство в зависимость от его строения, обобщая свой вывод и на других непредельных кетонах. При окислении пулегона марганцово-калиевой солью образуются ацетон и кислота С3Н12О4, оказавшаяся β-метиладипиновой как по своей способности переходить при окислении в лактонокислоту С7Н10O4, так и по способности образовать обычным путем β-метилкетопентаметилен. Кроме того, известен еще ход гидратации пулегона при нагревании с водой до 250° или с муравьиной кислотой до 100°; при этом образуются ацетон и β-метилкетогексаметилен (метил-1-циклогексанон-5). Из этих же самых продуктов при настаивании их с метилатом натрия удается обратно синтезировать пулегон. При попытках получить из пулегона хлоронитрозосоединение был получен нитрозопулегон, оказавшийся при дальнейшем исследовании бис-нитрозильным производным, в котором нитрозогруппа присоединилась не по месту этиленной связи, а заменила водород в прикарбонильной группе. При действии на пулегон бромистого водорода образуется бромгидрин С10Н17BrO; если от него отнимать HBr основной азотно-свинцовой солью, то образуется смесь 30% пулегона и 70% его изомера изопулегона; при восстановлении смеси алюминиевой амальгамой пулегон превращается в высококипящее двумолекулярное соединение, изопулегон не изменяется и может быть отделен перегонкой. Наиболее вероятной для изопулегона считается формула:
Изопулегон представляет жидкость, кип. при 98—100° при 13 мм, уд. в. 0,919, [α]D = —7°8′; он легко образуется при стоянии из цитронеллала (см. дальше). Остается еще упомянуть о двух соединениях состава C10H6O, одно из которых представляет предельный бициклический кетон — карон, другое же обладает этиленной связью и заключает окисное кольцо; о нем уже приходилось упоминать выше; соединение это — пинол. Карон — 3-метил-7-диметилбицикло-[0,1,4]-гептан-2-он — образуется при отнятии HBr от бромистоводородного дигидрокарвона.
Известны правый и левый оптические изомеры и соответственные производные. Карон относительно постоянен к марганцово-калиевой соли, присоединяет, однако, бром и галоидоводороды; с последними переходит обратно в дигидрокарвонные производные; при нагревании до кипения (около 210°) изомеризуется в карвенон. Образует оксимы, карбазоны и проч. При окислении марганцовокалиевой солью получены две весьма интересные кислоты, являющиеся цис- и трансизомерами и проливающие свет на строение карона. Кислоты эти циклические, диметилтриметилендикарбоновые — кароновые — указывают, что в кароне имеется триметиленное кольцо. Ход окисления карона является весьма интересной реакцией, особенно благодаря образованию цис- и транскислот, обладающих следующей конфигурацией:
Цискароновая к. кристаллична и плав. при 174—175°; при дальнейшем нагревании теряет воду и переходит в ангидрид, плав. при 54—56°. Последний при нагревании с водой обратно переходит в исходную кислоту. Транскислота плав. при 212° и в ангидрид не переходит. Обе кислоты предельны и при нагревании при 100° с раствором бромистого водорода переходят в теребиновую кислоту (см.), что подтверждает присутствие в них триметиленного кольца, раскрывающегося при этой реакции. Строение кароновых кислот подтверждено также и недавно воспроизведенным синтезом их из полных и неполных эфиров α-бром-ββ-диметилглутаровой кислоты — COOH—CHBr—C(СН3)2—СН2—СООН.
Пинол представляет окись, образующуюся при обработке бромистого терпинеола спиртовой щелочью; та же окись образуется, как было упомянуто, и при дегидратации собрерола; при обработке, с другой стороны, пинола бромистым водородом, а затем щелочью раскрывается окисное кольцо и получаются кристаллы, идентичные с собреролом, называвшиеся пинолгидратом. Пинол представляет жидкость с запахом, напоминающим камфору, кип. при 183—184°; d20 = 0,942. Он сыграл видную роль в установлении строения терпенных соединений, являясь связующим звеном между собреролом и терпинеолом и проч.; он был первым соединением, строение которого было прочно установлено, и из него уже шаг за шагом можно было раскрывать и подтверждать строение соединений, связанных взаимными переходами. Пинол присоединяет два атома брома, водные остатки, хлористый нитрозил, хлорноватистую кислоту и проч. При глубоком окислении дает кислоты теребиновую, терпениловую и уксусную, что весьма наглядно следует из его формулы строения. Из производных пинола мы укажем, что гликолы, получаемые, с одной стороны, окислением его марганцово-калиевой солью, с другой — обменом в бромюре брома на водные остатки, различны и являются стереоизомерами цистрансряда. Гликол из бромюра плав. при 125°, из пинола — при 128°—129°. Присоединение хлорноватистой кислоты к пинолу происходит по месту этиленной связи, при чем образуется монохлоргидрат пинолгликола; хлор при этом становится в третичном положении, а водный остаток во вторичном, так как при окислении хромовой смесью образуется хлоркетон. Под влиянием едкой щелочи хлоргидрин переходит в упомянутую при собрероле α-γ-двуокись; последняя при гидратации дает пинолгликол с темп. пл. 124°, т. е. аналогичный таковому из бромистого пинола.
Ментадиенол и ментадиенон — С10Н16О и С10Н14О. Карвеол Δ6(1),8-ментадиен-2-ол C10H15—OH, единственный представитель этого ряда; как таковой неизвестен; известен лишь его метиловый эфир (темп. кип. 208°—212°), который образуется из четырехбромистого лимонена или из бромистого терпинеола по замещении в нем водного остатка бромом и обработке полученного трибром-1,2,8-ментана спиртовой щелочью, или, наконец, из хлоронитрозотерпинеола. При окислении хромовой смесью эфир карвеола переходит в карвон. Карвон, Δ6(1),8-ментадиен-2-он — С10Н14О. Так как об этом кетоне уже упоминалось при лимонене, то здесь ограничимся указанием его свойств и некоторых переходов. Карвон представляет жидкость, кипящую при 223,5°, d°0 = 0,9598. Непосредственно он присоединяет одну лишь частицу галоидоводорода; образующейся продукт С10Н14OHCl способен, однако, дальше присоединять еще два атома брома; бром к самому карвону присоединяется в количестве четырех атомов. При нагревании с едкой щелочью или фосфорной кислотой карвон переходит в карвакрол. Из кетонов С10Н14О остается еще упомянуть о бициклическом непредельном кетоне, стоящем весьма близко к карону; кетон этот: эйкарвон — Δ3-4-метил-7-диметилбицикло-[0,1,4]-гептен-2-он — заключает, подобно карону, триметиленное кольцо и получается аналогично карону, если к карвону присоединить бромистый водород и отнять его.
При восстановлении эйкарвона натрием во влажном эфире наблюдается интересное направление реакции; образуется дигидроэйкарвеол, принадлежащий уже к новому классу моноциклических соединений, заключающих семичленное кольцо; раскрывается триметиленное кольцо по месту соединения обоих третичных углей:
Этиленная связь при этом восстановлении, как указывают продукты окисления дигидроэйкарвеола, также меняет свое положение. Заканчивая отдел Т. и их производных состава С10, нельзя не упомянуть о главнейших переходах из соединений с открытой цепью к соединениям терпенного ряда (циклическим). Так, в масле Geranium Reunion находится спирт С10H20О, названный цитронеллолем, который представляет соединение с 1 этиленной связью и, след., открытой цепью; он образует эфиры, при осторожном окислении переходит в альдегид C10H18O — цитронеллаль, при более же глубоком окислении распадается на β-метиладипиновую кислоту и ацетон, откуда и следует формула его строения:
(СН3)2С=CH—CH2—СН2—СН(СН3)—СН2—CH2ОН
Та же формула подтверждается переходом оксима цитронеллала под влиянием уксусного ангидрида в ментоноксим:
равно как превращением при стоянии чистого цитронеллала в изопулегон (см. выше). Затем известны два спирта С10Н18О — линалоол и гераниол: оба они распространены в природе и встречаются главным образом в разных лимонных и гераниевых маслах; реагируют они как соединения с двумя этиленными связями и обладают следующим строением:
линалоол (СН3)2С=СН—СН2—CH2—С(ОН)(СН3)—СН=СН2
гераниол (СН3)2С=СН—СН2—СН2—(CH3)С=CH—CH2ОН.
При продолжительном взбалтывании линалоола с разведенной серной кислотой он целиком переходит в терпингидрат; ту же реакцию воспроизводит и гераниол; кроме того, гераниол под влиянием серной и муравьиной кислот переходит в терпинен, а под влиянием хлористого водорода в дихлоргидрат дипентена.
III. Сесквитерпены. Сесквитерпены — C15H24 весьма распространены в природе, входя в состав большинства эфирных масел (и бальзамов); кроме того, сесквитерпены получаются и искусственно при перегонке каучука, равно как и при уплотнении гемитерпена — валерилена. Все сесквитерпены представляют жидкости, кипящие в пределах 255—280°, уд. в. их выше 0,9; некоторые из них вращают плоскость поляризации. Одни из них реагируют как соединения с одной этиленной связью, другие — как с двумя; в общем, однако, редко получаются характерные производные, почему разработка и разъяснение конституции сесквитерпенов находится пока лишь в начальном состоянии. Ввиду этого ограничимся указанием, что многие из известных сесквитерпенов характеризуются лишь своим образованием при дегидратации соответственных спиртов, встречающихся в растениях и несколько более характерных, нежели сами сесквитерпены; обратного, однако, перехода от углеводородов к тем же спиртам в большинстве случаев реализовать не удается. Изолированы до сих пор следующие 9 сесквитерпенов:
1) Кадинен — кипит при 274—275°
2) Кариофиллен " " 258—260°
3) Кловен " " 261—263°
4) Гумулен " " 263—266°
5) Пачулен " " 254—256°
6) Леден " " 255°
7) Гваяцен кип. при давл. в 13 м. 124—132°
8) Цедрен и 9) Кубебен.
IV. Политерпены. Политерпены тоже представляют соединения весьма распространенные, но в силу отсутствия характерных производных малоизученные. Дитерпены — С20Н32 представляют густые жидкости, кипящие между 310 и 330°; в их числе насчитываются: колофен, метатеребентен, паракайепутен, дитерпилен и дитерпен. Тритерпены — С30H48 представляют уже твердые тела, и в числе их хорошо изучены некоторые переходы одного из них — амирилена, спиртовое производное которого — амирин встречается в смоле элеми; амирилен известен в виде двух видоизменений α и β, α-амирилен плавится при 135°, β-амирилен — при 175—178°. Тетратерпен — C40H64 известен лишь один — тетратеребентен, плавящийся выше 100° и при перегонке распадающийся на колофен и терпен — C10H16. Из политерпенов дальнейшего уплотнения, не определенной еще частичной формулы, ограничимся лишь указанием на каучук (см.) и гуттаперчу (см.).
В заключение необходимо оговорить, что здесь почти не рассмотрены многие второстепенные терпенные отделы и производные, как то: фороны терпенного ряда, обширный класс аминных производных, нитрилы и пр., представляющие преимущественно частный интерес.
Литература. Fr. Heusler, «Die Terpene» (1896); M. Scholtz, «Die Terpene» («Sammlung chemischer Vorträge», 1896); G. Gildemeister und F. Hoffmann, «Die aetherischen Oele» (1899); Charabot, Dupont, Pillet, Crimaux, «Les huiles essentielles» (1899); А. Гинзберг, «Терпены и их производные» (XXX т. «Журн. Рус. физ.-хим. общ.», 1898; подробно приведена литература); в спец. химич. журналах многочисл. статьи Е. Вагнера («Ber. d. deutsch. Chem. Ges.», «Журн. Рус. физ.-хим. общ.», «Известия Варшавск. унив.», с 1894 г.), А. Baeyer’a, Bredt’a, Semmler’a, Tiemann’a и др. в «Ber. d. d. ch. G.», Wallach’a в «Annal. d. Chemie» и пр.